Ёлектронна€ библиотека
–≠–ї–µ–Ї—В—А–Њ–њ—А–Њ–≤–Њ–і–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–µ—Й–µ—Б—В–≤
–≠–ї–µ–Ї—В—А–Њ–њ—А–Њ–≤–Њ–і–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –≠–ї–µ–Ї—В—А–Њ–њ—А–Њ–≤–Њ–і–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —В–Є–њ–Њ–Љ –љ–Њ—Б–Є—В–µ–ї–µ–є —В–Њ–Ї–∞ –Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є —Б—А–µ–і—Л, –≤ –Ї–Њ—В–Њ—А–Њ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ—П–µ—В—Б—П —В–Њ–Ї. –Ф–µ—В–∞–ї—М–љ–Њ–µ —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ —Н–ї–µ–Ї—В—А–Њ–њ—А–Њ–≤–Њ–і–љ–Њ—Б—В–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —В–Њ–ї—М–Ї–Њ –љ–∞ –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–Љ —Г—А–Њ–≤–љ–µ, –∞ —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, —Б –њ–Њ–Љ–Њ—Й—М—О –Ј–∞–Ї–Њ–љ–Њ–≤ –Ї–≤–∞–љ—В–Њ–≤–Њ–є –Љ–µ—Е–∞–љ–Є–Ї–Є –∞—В–Њ–Љ–Њ–≤ –Є –Љ–Њ–ї–µ–Ї—Г–ї.
–≠–ї–µ–Ї—В—А–Њ–њ—А–Њ–≤–Њ–і–љ–Њ—Б—В—М –њ—А–Њ–≤–Њ–і–љ–Є–Ї–Њ–≤ (–Љ–µ—В–∞–ї–ї–Њ–≤). –Т–Њ–ї—М—В-–∞–Љ–њ–µ—А–љ–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –Љ–µ—В–∞–ї–ї–Њ–≤ –Є–Љ–µ–µ—В —В–Є–њ–Є—З–љ—Л–є –≤–Є–і, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–є –Ј–∞–Ї–Њ–љ—Г –Ю–Љ–∞ I = U/R. –Ґ–∞–Ї–∞—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –≤ –Њ—З–µ–љ—М —И–Є—А–Њ–Ї–Њ–Љ –і–Є–∞–њ–∞–Ј–Њ–љ–µ —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л.
–Ґ–µ–Љ–њ–µ—А–∞—В—Г—А–љ–∞—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П. –Ф–ї—П –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ —З–Є—Б—В—Л—Е –Љ–µ—В–∞–ї–ї–Њ–≤ —Г–і–µ–ї—М–љ–Њ–µ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ –ї–Є–љ–µ–є–љ–Њ –Ј–∞–≤–Є—Б–Є—В –Њ—В —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л:
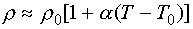 (15.1)
(15.1)
–Ч–і–µ—Б—М r0 - –Ј–љ–∞—З–µ–љ–Є–µ —Г–і–µ–ї—М–љ–Њ–≥–Њ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П –њ—А–Є –љ–µ–Ї–Њ—В–Њ—А–Њ–є –≤—Л–±—А–∞–љ–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ T0, a - —В–µ–Љ–њ–µ—А–∞—В—Г—А–љ—Л–є –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П, [a] = K-1. –І–Є—Б–ї–µ–љ–љ–Њ —Н—В–Њ—В –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –і–ї—П –≤—Б–µ—Е –Љ–µ—В–∞–ї–ї–Њ–≤ –њ–Њ—А—П–і–Ї–∞ 10-3 –Ъ-1. –Ш–љ—Л–Љ–Є —Б–ї–Њ–≤–∞–Љ–Є, —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ –Љ–µ—В–∞–ї–ї–Њ–≤ —Б–ї–∞–±–Њ –Ј–∞–≤–Є—Б–Є—В –Њ—В —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤–Њ –≤—Б–µ–Љ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –і–Њ–њ—Г—Б—В–Є–Љ—Л—Е —В–µ–Љ–њ–µ—А–∞—В—Г—А –Њ—В —В–Њ—З–Ї–Є –њ–ї–∞–≤–ї–µ–љ–Є—П –і–Њ —Б–≤–µ—А—Е–љ–Є–Ј–Ї–Є—Е.
–£ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Љ–µ—В–∞–ї–ї–Њ–≤ (–љ–∞–њ—А–Є–Љ–µ—А, —А—В—Г—В—М, –Њ–ї–Њ–≤–Њ) —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ –≤–љ–µ–Ј–∞–њ–љ–Њ –њ–∞–і–∞–µ—В –і–Њ –љ—Г–ї—П –њ—А–Є –Њ—Е–ї–∞–ґ–і–µ–љ–Є–Є –љ–Є–ґ–µ –љ–µ–Ї–Њ—В–Њ—А–Њ–є –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –Ґ—Б. –≠—В–Њ —П–≤–ї–µ–љ–Є–µ –њ–Њ–ї—Г—З–Є–ї–Њ –љ–∞–Ј–≤–∞–љ–Є–µ —Б–≤–µ—А—Е–њ—А–Њ–≤–Њ–і–Є–Љ–Њ—Б—В–Є. –Ґ–Є–њ–Є—З–љ—Л–µ —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –њ–µ—А–µ—Е–Њ–і–∞ –≤ —Б–≤–µ—А—Е–њ—А–Њ–≤–Њ–і—П—Й–µ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Г –Љ–µ—В–∞–ї–ї–Њ–≤ –Њ—З–µ–љ—М –Љ–∞–ї—Л (< 20 –Ъ).
–≠–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Є–є —В–Њ–Ї –≤ –ґ–Є–і–Ї–Њ—Б—В—П—Е. –Т–Њ–і–љ—Л–µ —А–∞—Б—В–≤–Њ—А—Л —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤ –њ—А–Њ–≤–Њ–і—П—В —В–Њ–Ї. –Э–Њ—Б–Є—В–µ–ї—П–Љ–Є —В–Њ–Ї–∞ —П–≤–ї—П—О—В—Б—П –Є–Њ–љ—Л —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–∞, –Њ–±—А–∞–Ј–Њ–≤–∞–≤—И–Є–µ—Б—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —А–∞–Ј–ї–Њ–ґ–µ–љ–Є—П –Љ–Њ–ї–µ–Ї—Г–ї —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–∞ –≤ –≤–Њ–і–љ–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ. –Т —А–∞—Б—В–≤–Њ—А–µ —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–∞ –љ–µ–њ—А–µ—А—Л–≤–љ–Њ –Ї–Њ–љ–Ї—Г—А–Є—А—Г—О—В –њ—А–Њ—Ж–µ—Б—Б—Л –і–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –Є –Њ–±—А–∞—В–љ–Њ–є —А–µ–Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Є–Њ–љ–Њ–≤ –≤ –Љ–Њ–ї–µ–Ї—Г–ї—Л —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–∞. –Я—А–Є –Ј–∞–і–∞–љ–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–µ —А–∞–≤–љ–Њ–≤–µ—Б–Є–µ –Є —Б—А–µ–і–љ–µ–µ —З–Є—Б–ї–Њ –Є–Њ–љ–Њ–≤ –Њ–±–Њ–Є—Е –Ј–љ–∞–Ї–Њ–≤ –љ–µ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П. –°—В–µ–њ–µ–љ—М –і–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є (–і–Њ–ї—П –Љ–Њ–ї–µ–Ї—Г–ї —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–∞, —А–∞—Б–њ–∞–≤—И–Є—Е—Б—П –љ–∞ –Є–Њ–љ—Л) —А–∞—Б—В–µ—В —Б —А–Њ—Б—В–Њ–Љ —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л, –њ–Њ—Н—В–Њ–Љ—Г –≤ –љ–∞–≥—А–µ—В–Њ–Љ —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е –Є –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –Є–Њ–љ–Њ–≤ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П.
–Ч–∞–Ї–Њ–љ —Н–ї–µ–Ї—В—А–Њ–ї–Є–Ј–∞. –Ш–Њ–љ—Л - –њ—А–Њ–≤–Њ–і–љ–Є–Ї–Є —В–Њ–Ї–∞ –≤ —А–∞—Б—В–≤–Њ—А–µ —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–∞ - –њ–Њ–њ–∞–і–∞—О—В –љ–∞ —Н–ї–µ–Ї—В—А–Њ–і—Л –Є, –Њ—В–і–∞–≤–∞—П, –ї–Є–±–Њ –њ–Њ–ї—Г—З–∞—П —Н–ї–µ–Ї—В—А–Њ–љ—Л, –њ—А–µ–≤—А–∞—Й–∞—О—В—Б—П –≤ –∞—В–Њ–Љ—Л —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –≤–µ—Й–µ—Б—В–≤. –Я—А–Њ—Ж–µ—Б—Б –≤—Л–і–µ–ї–µ–љ–Є—П –≤–µ—Й–µ—Б—В–≤–∞ –љ–∞ —Н–ї–µ–Ї—В—А–Њ–і–∞—Е –њ—А–Є –њ—А–Њ–њ—Г—Б–Ї–∞–љ–Є–Є —В–Њ–Ї–∞ —З–µ—А–µ–Ј —А–∞—Б—В–≤–Њ—А —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–∞ –љ–∞–Ј—Л–≤–∞–µ—В—Б—П —Н–ї–µ–Ї—В—А–Њ–ї–Є–Ј–Њ–Љ.
–Я—Г—Б—В—М m0i - –Љ–∞—Б—Б–∞ –Њ—В–і–µ–ї—М–љ–Њ–≥–Њ –Є–Њ–љ–∞, q0i = ne - –µ–≥–Њ –Ј–∞—А—П–і (n - –≤–∞–ї–µ–љ—В–љ–Њ—Б—В—М –Є–Њ–љ–∞, –µ - –≤–µ–ї–Є—З–Є–љ–∞ —Н–ї–µ–Љ–µ–љ—В–∞—А–љ–Њ–≥–Њ –Ј–∞—А—П–і–∞), –∞ Ni - —З–Є—Б–ї–Њ –Є–Њ–љ–Њ–≤, –њ–Њ–њ–∞–≤—И–Є—Е –љ–∞ —Н–ї–µ–Ї—В—А–Њ–і –Ј–∞ –≤—А–µ–Љ—П Dt. –Я–Њ–ї–љ—Л–є –Ј–∞—А—П–і, –њ—А–Њ—И–µ–і—И–Є–є –Ј–∞ —Н—В–Њ –≤—А–µ–Љ—П —З–µ—А–µ–Ј —Н–ї–µ–Ї—В—А–Њ–ї–Є—В, —А–∞–≤–µ–љ Dq = IDt, –њ–Њ—Н—В–Њ–Љ—Г
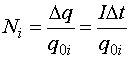
–Ь–∞—Б—Б–∞ –≤–µ—Й–µ—Б—В–≤–∞, –≤—Л–і–µ–ї–Є–≤—И–∞—П—Б—П –љ–∞ —Н–ї–µ–Ї—В—А–Њ–і–µ, —А–∞–≤–љ–∞
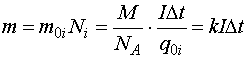 (15.2)
(15.2)
–Ъ–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В
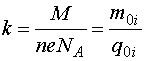
–љ–Њ—Б–Є—В –љ–∞–Ј–≤–∞–љ–Є–µ —Н–ї–µ–Ї—В—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–∞. –≠—В–∞ –≤–µ–ї–Є—З–Є–љ–∞ —А–∞–Ј–ї–Є—З–љ–∞ –і–ї—П —А–∞–Ј–љ—Л—Е –≤–µ—Й–µ—Б—В–≤.
–Я–Њ–ї—Г—З–µ–љ–љ–∞—П —Д–Њ—А–Љ—Г–ї–∞ (15.2) –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –Њ—Б–љ–Њ–≤–љ–Њ–є –Ј–∞–Ї–Њ–љ —Н–ї–µ–Ї—В—А–Њ–ї–Є–Ј–∞ (–Ј–∞–Ї–Њ–љ –§–∞—А–∞–і–µ—П):
–Ь–∞—Б—Б–∞ –≤–µ—Й–µ—Б—В–≤–∞, –≤—Л–і–µ–ї–Є–≤—И–µ–≥–Њ—Б—П –љ–∞ —Н–ї–µ–Ї—В—А–Њ–і–µ, –њ—А—П–Љ–Њ –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–∞ –Ї–Њ–ї–Є—З–µ—Б—В–≤—Г –Ј–∞—А—П–і–∞ Dq, –њ—А–Њ—В–µ–Ї—И–µ–Љ—Г —З–µ—А–µ–Ј —А–∞—Б—В–≤–Њ—А —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–∞. –Я–Њ—Б—В–Њ—П–љ–љ–∞—П –≤–µ–ї–Є—З–Є–љ–∞ QF = eNA = 96500 –Ъ–ї –љ–∞–Ј—Л–≤–∞–µ—В—Б—П –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –§–∞—А–∞–і–µ—П. –Я—А–Є –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є–Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ј–∞—А—П–і–∞ QF –љ–∞ —Н–ї–µ–Ї—В—А–Њ–і–µ –≤—Л–і–µ–ї—П–µ—В—Б—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤–µ—Й–µ—Б—В–≤–∞, —А–∞–≤–љ–Њ–µ –Љ–∞—Б—Б–µ –Њ–і–љ–Њ–≥–Њ –Љ–Њ–ї—П –≤–µ—Й–µ—Б—В–≤–∞, –і–µ–ї–µ–љ–љ–Њ–є –љ–∞ –≤–∞–ї–µ–љ—В–љ–Њ—Б—В—М –Є–Њ–љ–∞-–љ–Њ—Б–Є—В–µ–ї—П.



